神経分子形態学分野
概要
本分野では主に網膜と海馬という二つの中枢神経領域をモデルにした神経研究を行っている。網膜グループ(藤枝教授ら)は網膜の発生と再生を専門とし、発生期網膜の細胞増殖と分化を制御する分子機構の解明、網膜幹細胞を用いた網膜再生の賦活化法の探索を行っている。海馬グループ(本多准教授ら)は神経トレーサーおよびウィルスベクター注入法を駆使して、大脳皮質の海馬周辺領域における神経結合を検討し、記憶形成に関わる神経回路網の解明を目指している。解剖学教室ならではの「かたち」へのこだわりがあるが、「かたち」だけにとどまらない、遺伝子から臓器まで幅広い視野をもった研究を目指している。なお、学部教育では肉眼解剖学を専門としているので、大学院においても肉眼解剖学の講義と実習を受講することが可能である。
研究可能テーマ
(1)発生期網膜における細胞増殖・分化制御機構(藤枝)
網膜は中枢神経系の一部であり、6種類の神経細胞と1種類のグリア細胞(Müller細胞)から構成される。発生期には未分化な網膜前駆細胞が分裂して細胞数を増やすが、やがて細胞運命が決定し、細胞周期から出て分化が進行する。こうした細胞増殖、分化のプロセスを制御する分子機構はいまだ不明な点が多い。
本研究では、網膜を構成する細胞の増殖・分化制御機構の解明を目的とし、主に細胞周期制御因子、転写因子、エピジェネティック因子に着目して、その発現と機能を組織学的、分子生物学的、遺伝子工学的手法を用いて解析している。
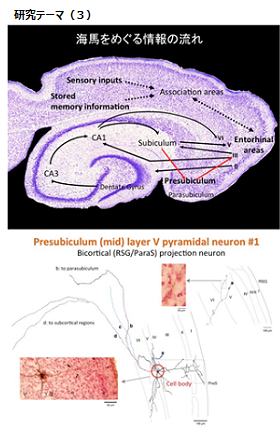
(3)記憶をつくる神経回路の繋がり方を解剖学的に調べる(本多)
網膜は中枢神経系の一部であり、6種類の神経細胞と1種類のグリア細胞(Müller細胞)から構成される。発生期には未分化な網膜前駆細胞が分裂して細胞数を増やすが、やがて細胞運命が決定し、細胞周期から出て分化が進行する。こうした細胞増殖、分化のプロセスを制御する分子機構はいまだ不明な点が多い。
本研究では、網膜を構成する細胞の増殖・分化制御機構の解明を目的とし、主に細胞周期制御因子、転写因子、エピジェネティック因子に着目して、その発現と機能を組織学的、分子生物学的、遺伝子工学的手法を用いて解析している。

(2)網膜グリア細胞による視細胞再生(藤枝)
下等脊椎動物の網膜では組織損傷に際してMüller細胞が脱分化・増殖し、神経に再分化して網膜を再生することが知られているが、哺乳類ではMüller細胞の再生能は極めて限られている。
本研究ではマウスおよびラットの視細胞変性モデルを用いて、哺乳類網膜においてMüller細胞の再生能力が抑制されている要因を探索し、それを人為的にコントロールすることによりMüller細胞による網膜再生の賦活化を試みる。長期的には網膜変性疾患の新しい再生治療の開発に寄与することを目的としている。
(3)記憶をつくる神経回路の繋がり方を解剖学的に調べる(本多)
脳の側頭葉にある海馬と、嗅内野を始めとする海馬周辺の脳領域は、記憶・学習の形成に必須の部位として、またてんかんやアルツハイマー病における重要な病変部位として知られる。近年では空間ナビゲーションに関与する種々な活動特性を持ったニューロンがこれらの領域に発見され、話題を集めている。しかし海馬と海馬周辺の脳領域を繋ぐ神経回路網の詳細はいまだに不明な点が多い。
本研究ではさまざまなトレーサーを動物の脳内に注入し連続切片上で標識された細胞体もしくは神経終末の位置を確認することにより、これらの領域間の緻密な神経線維連絡を一つ一つ可視化し明らかにしていく。
本研究ではさまざまなトレーサーを動物の脳内に注入し連続切片上で標識された細胞体もしくは神経終末の位置を確認することにより、これらの領域間の緻密な神経線維連絡を一つ一つ可視化し明らかにしていく。

まずは基本モデルとしてラット海馬周辺領域の神経結合を全体的に明らかにし、さらに大脳辺縁系が比較的良く発達しているウサギ、霊長類モデルとしてマーモセットについても同様に海馬と海馬周辺領域の結合関係を調べ比較する。これら動物種を超えて共通に存在する「記憶回路の基本型」は何なのか?この「基本型」に加えて霊長類などで新たに生じる神経連絡があるならば、それは何か? 以上の疑問に対する答えを得た上で、最終的にヒトにおける海馬および海馬周辺皮質の機能解明に繋げることを目的とする。
本研究では、トレーサーを用いた古典的手法で記憶に関わる神経回路を「細胞集団」のレベルで明らかにする一方、GFP発現遺伝子を組み込んだウイルスベクターをラット脳内に注入し単一神経細胞の軸索のすべての枝を最後まで可視化する手法により「個々のニューロン」のレベルでも繋がり方を明らかにする。これは多数の軸索分岐の隅々に到るまで最も効率的に可視化できる現在唯一の方法であり、通常の標識物質注入法では可視化できなかった神経線維形態を本研究で初めて確認できる可能性が高い。その結果、これまでの手法では可視化されず(したがって報告されることのなかった)未知の神経線維連絡を複数発見するに至っている。
(4)記憶障害の自然回復に関わる再神経支配メカニズムの形態学的解析(本多)
嗅内野から海馬体へは記憶形成に必須な多量の入力があり、これが片側のみ傷害されると反対側の正常嗅内野からの海馬体入力線維が増加する(再神経支配)という現象がラットで報告されている。しかしこの片側嗅内野損傷後の再支配軸索線維が実際に海馬体内部でどのように分布・走行するのかを形態学的に明らかにした報告はない。記憶障害の自然回復に関わるこの再神経支配現象のメカニズムを解明する目的で、片側嗅内野傷害ラットモデルにおける反対側嗅内野からの軸索線維走行・分岐パターンが単一ニューロンレベルでどのように変化しているのかを、GFP発現遺伝子を組み込んだウイルスベクターを用いて形態学的に解析する。
本研究では、トレーサーを用いた古典的手法で記憶に関わる神経回路を「細胞集団」のレベルで明らかにする一方、GFP発現遺伝子を組み込んだウイルスベクターをラット脳内に注入し単一神経細胞の軸索のすべての枝を最後まで可視化する手法により「個々のニューロン」のレベルでも繋がり方を明らかにする。これは多数の軸索分岐の隅々に到るまで最も効率的に可視化できる現在唯一の方法であり、通常の標識物質注入法では可視化できなかった神経線維形態を本研究で初めて確認できる可能性が高い。その結果、これまでの手法では可視化されず(したがって報告されることのなかった)未知の神経線維連絡を複数発見するに至っている。
(4)記憶障害の自然回復に関わる再神経支配メカニズムの形態学的解析(本多)
嗅内野から海馬体へは記憶形成に必須な多量の入力があり、これが片側のみ傷害されると反対側の正常嗅内野からの海馬体入力線維が増加する(再神経支配)という現象がラットで報告されている。しかしこの片側嗅内野損傷後の再支配軸索線維が実際に海馬体内部でどのように分布・走行するのかを形態学的に明らかにした報告はない。記憶障害の自然回復に関わるこの再神経支配現象のメカニズムを解明する目的で、片側嗅内野傷害ラットモデルにおける反対側嗅内野からの軸索線維走行・分岐パターンが単一ニューロンレベルでどのように変化しているのかを、GFP発現遺伝子を組み込んだウイルスベクターを用いて形態学的に解析する。
スタッフ紹介
教授・基幹分野長 藤枝 弘樹
准教授 本多 祥子

准教授 本多 祥子


