お知らせ
2021年12月09日 【プレスリリース】全ゲノム解析等の網羅的ゲノム解析による消化器神経内分泌がんの病態解明
全ゲノム解析等の網羅的ゲノム解析による消化器神経内分泌がんの病態解明
~世界に先駆けて難敵ながんの本態を解き明し、薬剤開発の推進に期待~
| 【 研究成果ポイント】 ・難治がんである消化器の神経内分泌がん(NEC(ネック):NeuroEndocrine Carcinoma)の発症メカニズムを網羅的ゲノム解析により徹底解明した。 ・消化器NECは希少がんでかつ診断時には手術適応となることが極めて少ないため、研究試料の入手が難しく、これまで、そのゲノム異常はほとんど未解明であった。 ・初めて明らかとなった消化器NECの発症メカニズムを基に、開発中の分子標的薬のドラッグ・リポジショニングや新規創薬の推進が期待される。 |
1.概要
 大阪大学大学院医学系研究科/国立がん研究センター研究所の谷内田真一教授(がんゲノム情報学)/ゲノム医科学分野長らの研究グループは、日米欧のサンプルを用いて全ゲノム解析※1 等の最先端の解析を行い、難治がんである消化器神経内分泌がん(NEC)を対象に、その発がんメカニズムを解明しました(図1)。
大阪大学大学院医学系研究科/国立がん研究センター研究所の谷内田真一教授(がんゲノム情報学)/ゲノム医科学分野長らの研究グループは、日米欧のサンプルを用いて全ゲノム解析※1 等の最先端の解析を行い、難治がんである消化器神経内分泌がん(NEC)を対象に、その発がんメカニズムを解明しました(図1)。また、2019年の消化器のWHO分類では、NECと神経内分泌腫瘍(NeuroEndocrine Tumor:NET(ネット))の病理像により分類されましたが、今回の網羅的ゲノム解析により、発症メカニズムに伴う遺伝子異常に差異があることを実証しました。NEC の大きな特徴として、神経内分泌系への分化をつかさどる転写因子※2である SOX2(山中因子の一つ) やASCL1 が高発現していました。
さらに、NECにおけるこれらの転写因子の過剰発現は、各遺伝子のプロモーター領域のメチル化※3に起因していることを明らかにしました。一般的にはプロモーター領域の脱メチル化により遺伝子の発現が増加することが知られていますが、それとは逆の機構であることを解明しました。
膵臓由来のと胃や大腸などの非膵臓消化器由来のNEC の病理組織像は類似していますが、今回の解析からゲノム異常には類似している点と異なる点があることも明らかとなりました。加えて新たに、膵臓由来のはそのゲノム異常の違いから「(腺管型)」と「(腺房型)」に分類できることを発見しました。これは、膵臓のの起源となる細胞には複数のものが存在する可能性を示唆しています。さらに、消化管NECの発がん要因のひとつに、ウイルス感染が関係していることも明らかとなりました(メルケル細胞ポリオーマウイルスやヒトパピローマウイルス)。
今後、今回明らかとなった消化器のNEC の発症メカニズムを基に、開発中の分子標的薬のドラッグ・リポジショニングや新規創薬が推進されることが期待されます。
本研究成果は、米国がん学会誌「Cancer Discovery, a journal of the American Association for Cancer Research(インパクトファクター:39.40)」に、12月9日(木)午前0時(日本時間)に公開されました。
 消化器の神経内分泌系の新生物(NENs:Neuroendocrine neoplasms)は免疫組織化学染色で、神経内分泌系のマーカーであるシナプトフィジンやクロモグラニンAが陽性となる希少な疾患です。NENsは臓器横断的に発症しますが、消化器、特に膵臓が主な原発臓器です。2010年のWHO分類では、細胞増殖の程度と核分裂像数による悪性度に応じてG1、G2、G3に分類されていました。しかし、このG3の中には予後が比較的良いものと極めて予後不良のものが混在していたため、2019年のWHO分類では、NENsをまず病理組織像により神経内分泌腫瘍(NET)と神経内分泌がん(NEC)に分類しました。さらにNETを細胞増殖の程度と核分裂像数でG1、G2、G3に分類することに修正されました (図2)。一方で、NECは病理組織像から、Small-cell type(小細胞型)とLarge-cell type(大細胞型)に分類されました。Small-cell typeは小細胞肺がんに組織像が類似しています。
消化器の神経内分泌系の新生物(NENs:Neuroendocrine neoplasms)は免疫組織化学染色で、神経内分泌系のマーカーであるシナプトフィジンやクロモグラニンAが陽性となる希少な疾患です。NENsは臓器横断的に発症しますが、消化器、特に膵臓が主な原発臓器です。2010年のWHO分類では、細胞増殖の程度と核分裂像数による悪性度に応じてG1、G2、G3に分類されていました。しかし、このG3の中には予後が比較的良いものと極めて予後不良のものが混在していたため、2019年のWHO分類では、NENsをまず病理組織像により神経内分泌腫瘍(NET)と神経内分泌がん(NEC)に分類しました。さらにNETを細胞増殖の程度と核分裂像数でG1、G2、G3に分類することに修正されました (図2)。一方で、NECは病理組織像から、Small-cell type(小細胞型)とLarge-cell type(大細胞型)に分類されました。Small-cell typeは小細胞肺がんに組織像が類似しています。NETは手術で根治することも多いことから、手術残余検体を用いた研究が進められており、これまでにMEN1などの複数の原因遺伝子が同定されています。一方でNECは、極めて稀で診断時に遠隔転移を認めることが多いため手術適応患者は少なく、研究試料の入手が難しいことからこれまで大規模な網羅的ゲノム解析は行われていませんでした。
3.研究の内容
本研究では、消化器のNETとNEC(計115症例)の網羅的ゲノム解析(全ゲノム解析、全エクソーム解析、全トランスクリプトーム解析(RNA-seq)、メチル化解析とATAC-seq解析※4)を行った結果、その発症メカニズムが全く異なることから、両者は別の疾患であることを実証しました。
膵臓由来NECは「Ductal-type」と「Acinar-type」に分類でき、起源細胞が異なる可能性があるNECは臓器別に膵臓由来と非膵臓消化器由来に分類して解析しました。病理組織像は類似していますが、ゲノム異常は類似している点と異なる点があります。膵臓由来のNECではTP53とRB1遺伝子の異常が特徴的です。さらに、膵臓由来NECは、「Ductal-type」と「Acinar-type」に分類できることを発見しました。
前者はKRAS遺伝子の変異を有し、膵臓の腺管細胞マーカー遺伝子(SPP1やCFTR)の発現が上昇しています。後者はKRAS変異がなく、膵臓の腺房細胞マーカーの遺伝子(PTF1A)が高発現しています。「Ductal-type」のNECと「Acinar-type」のNECの違いは、膵臓におけるそれぞれの起源細胞が異なることに起因すると考えられます。「Ductal-type」は通常型膵臓がんにも高頻度に見られるKRAS変異を有することから起源細胞が共通である可能性がありますが、通常型膵臓がんでみられるCDKN2AやSMAD4遺伝子の異常はほとんどないことから、早い時期に通常型膵臓がんとDuctal-type NECに方向性が分かれるのではないかと考えられます(図3)。

膵臓由来NECと非膵臓消化器由来NECのゲノム異常は異なる点がある
 非膵臓消化器由来のNECでは、①TP53とRB1遺伝子の異常、もしくは②TP53とCCNE1 or MYC遺伝子の異常(①と②は相互排他的)が特徴的で、さらに構造多型※5が多いことが明らかとなりました。非膵臓消化器由来のNECでは、Notch遺伝子ファミリーの異常も特徴的に認められました。実際に、大腸粘膜由来オルガノイド※6を用いてNotch シグナルの抑制が神経内分泌マーカーであるシナプトフィジン陽性細胞を誘導することを検証しました(図4)。5年生存率は膵臓由来のNECが非膵臓消化器由来のNECと比較して、有意に予後不良でした。さらに胃NECと大腸NECのそれぞれの一例は、ウイルス感染が原因となってがん発生していることが明らかとなりました(胃NEC:メルケル細胞ポリオーマウイルス、大腸NEC:ヒトパピローマウイルス)。このようなウイルス発がんの場合はTP53とRB1遺伝子の異常はありませんでした。
非膵臓消化器由来のNECでは、①TP53とRB1遺伝子の異常、もしくは②TP53とCCNE1 or MYC遺伝子の異常(①と②は相互排他的)が特徴的で、さらに構造多型※5が多いことが明らかとなりました。非膵臓消化器由来のNECでは、Notch遺伝子ファミリーの異常も特徴的に認められました。実際に、大腸粘膜由来オルガノイド※6を用いてNotch シグナルの抑制が神経内分泌マーカーであるシナプトフィジン陽性細胞を誘導することを検証しました(図4)。5年生存率は膵臓由来のNECが非膵臓消化器由来のNECと比較して、有意に予後不良でした。さらに胃NECと大腸NECのそれぞれの一例は、ウイルス感染が原因となってがん発生していることが明らかとなりました(胃NEC:メルケル細胞ポリオーマウイルス、大腸NEC:ヒトパピローマウイルス)。このようなウイルス発がんの場合はTP53とRB1遺伝子の異常はありませんでした。消化器NECは脱メチル化ではなくメチル化により神経内分泌系の転写因子(SOX2など)が高発現している
NECの大きな特徴は、神経内分泌系への分化をつかさどる転写因子であるSOX2やASCL1が高発現していることであり、これは各遺伝子のプロモーター領域のメチル化に起因することを発見しました。一般的には、プロモーター領域の脱メチル化により遺伝子の発現が増加しますが、最近ではこのような逆の現象も報告されています。さらにATAC-seq解析では、SOX2の発現が高いNECにおいてSOX2周辺がオープンクロマチン構造となっている、すなわち遺伝子の転写が促進されていることを明らかにしました。
消化器NECから腺がんや扁平上皮がんに分化する可能性
NECの病理組織では、通常の腺がんや扁平上皮がんも観察されることがあり、その成分が30%以上ある場合は、MiNEN(mixed neuroendocrine-non-neuroendocrine neoplasm)と呼ばれます。これまでMiNENの多くは腺がんや扁平上皮がんが神経内分泌系に分化してNECになると考えられてきました。しかし本研究では、両成分のゲノム異常を比較することで、これまでの概念を覆すようなNECにさらに遺伝子異常が蓄積し、腺がんや扁平上皮がんになる可能性を示唆する所見も観察されました。
消化器 NETの発症メカニズムはNECとは全く異なる
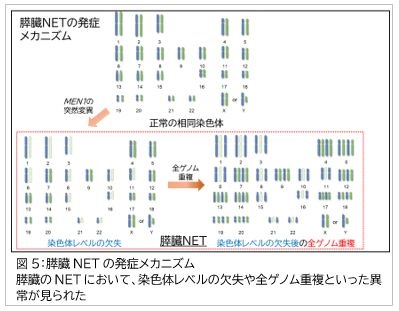 一方、NETはNECとは全く別のメカニズムで発症することを実証しました。NETにおいては、NECの多くで観察されるRB1遺伝子の異常はみられませんでした。遺伝子変異はNECと比較して少数で、変異を有する主要な遺伝子はMEN1、DAXX、VHL遺伝子です。興味深いことに、膵臓NETの約40%で多数の染色体レベルの欠失(染色体1、2、3、6、8、10、11、15、16、21と22番)が起こっており、これらの約3分の2の症例はMEN1遺伝子の突然変異を有していました。また、多数の染色体で欠失が起きていた症例の約2分の1の症例では、欠失の後に全ゲノム重複※7が起きていたことも分かりました(図5)。MEN1遺伝子はMeninと呼ばれるタンパク質をコードしており、Meninは染色体の構造維持やDNA修復に関与していることが知られています。これらのことから、MEN1遺伝子変異が細胞分裂の際に染色体の分離機構を不安定にさせ、こういった現象を引き起こしたものと推察されます。
一方、NETはNECとは全く別のメカニズムで発症することを実証しました。NETにおいては、NECの多くで観察されるRB1遺伝子の異常はみられませんでした。遺伝子変異はNECと比較して少数で、変異を有する主要な遺伝子はMEN1、DAXX、VHL遺伝子です。興味深いことに、膵臓NETの約40%で多数の染色体レベルの欠失(染色体1、2、3、6、8、10、11、15、16、21と22番)が起こっており、これらの約3分の2の症例はMEN1遺伝子の突然変異を有していました。また、多数の染色体で欠失が起きていた症例の約2分の1の症例では、欠失の後に全ゲノム重複※7が起きていたことも分かりました(図5)。MEN1遺伝子はMeninと呼ばれるタンパク質をコードしており、Meninは染色体の構造維持やDNA修復に関与していることが知られています。これらのことから、MEN1遺伝子変異が細胞分裂の際に染色体の分離機構を不安定にさせ、こういった現象を引き起こしたものと推察されます。NETは細胞増殖の程度と細胞分裂像でG1、G2、G3に分類されます。G1やG2からG3へと悪性度が進む過程で、TP53やCDKN2Aなどの遺伝子異常が蓄積することも解明しました。
本研究成果により、希少かつ難治がんである消化器NECの発症・進展メカニズムが全ゲノムレベルで明らかになりました。NECは、同じ臓器由来の通常型のがん(腺がんや扁平上皮がん)とは異なるゲノム異常を有し、既存の分子標的薬等の薬剤ターゲットとなる遺伝子異常が少なく、現状では難治性のがんであることも分かりました。しかし、複雑で多様な病態を詳細に解析し、発がんメカニズムに基づいて新たなサブグループを定義づけることで、開発中の分子標的薬のドラッグ・リポジショニングや新規創薬が推進されることが期待されます。
5.特記事項
本研究成果は、2021年12月9日(木)午前0時(日本時間)〔12月8日(水)午前10時(米国東部時間)〕に米国科学誌「Cancer Discovery」(オンライン)に掲載されました。
【タイトル】 “Comprehensive Genomic Profiling of Neuroendocrine Carcinomas of the Gastrointestinal System”
【著者名】Shinichi Yachida1,2,3*†, Yasushi Totoki4†, Michaël Noë5,6†, Yoichiro Nakatani1†, Masafumi Horie1†, Kenta Kawasaki7, Hiromi Nakamura4, Mihoko Saito-Adachi4, Masami Suzuki1, Erina Takai1, Natsuko Hama4, Ryota Higuchi8, Seiko Hirono9, Satoshi Shiba4, Mamoru Kato10, Eisaku Furukawa10, Yasuhito Arai4, Hirofumi Rokutan4, Taiki Hashimoto11, Shuichi Mitsunaga12, Mitsuro Kanda13, Hidenori Tanaka1, So Takata1, Ayaka Shimomura14, Minoru Oshima14, Wenzel M. Hackeng15, Tomoyuki Okumura16, Keiichi Okano14, Masakazu Yamamoto8, Hiroki Yamaue9, Chigusa Morizane17, Koji Arihiro18, Toru Furukawa19, Toshiro Sato7, Tohru Kiyono20, Lodewijk A. A. Brosens15, Laura D. Wood5,6, Ralph H. Hruban5,6, Tatsuhiro Shibata4,21
*責任著者、†筆頭著者(同等貢献)
【所属】
大阪大学大学院医学系研究科 がんゲノム情報学
大阪大学先導的学際研究機構 生命医科学融合フロンティア研究部門
国立がん研究センター研究所 ゲノム医科学分野
国立がん研究センター研究所 がんゲノミクス分野
Sol Goldman Pancreatic Cancer Research Center, Department of Pathology, Johns Hopkins Medical Institutions, Baltimore, Maryland, USA
Sol Goldman Pancreatic Cancer Research Center, Department of Oncology, Johns Hopkins Medical Institutions, Maryland, USA
慶應義塾大学医学部 坂口光洋記念講座(オルガノイド医学)
東京女子医科大学 消化器・一般外科
和歌山県立医科大学 外科学第2講座
国立がん研究センター研究所 生物情報学分野
国立がん研究センター中央病院 病理診断科
国立がん研究センター東病院 肝胆膵内科
名古屋大学大学院医学系研究科 総合医学専攻 病態外科学
香川大学医学部 消化器外科学
Department of Pathology, University Medical Center Utrecht, Utrecht University, Utrecht, The Netherlands
富山大学 学術研究部医学系 消化器・腫瘍・総合外科
国立がん研究センター中央病院 肝胆膵内科
広島大学病院 病理診断科
東北大学大学院医学系研究科 病態病理学分野
国立がん研究センター先端医療開発センター HPV関連がん予防・治療プロジェクト
東京大学医科学研究所 ゲノム医科学分野
DOI:10.1158/2159-8290.CD-21-0669
なお、本研究は、AMED 次世代がん医療創生研究事業(研究開発課題名:統合的ゲノム解析による消化器神経内分泌がんの本態解明)等の一環として行われました。
【谷内田真一教授のコメント】
本疾患は希少がんであることから、病気の名前も知らなかった方が多いと思います。全ゲノム解析等の網羅的解析を行うために研究試料、特に新鮮凍結サンプルの収集に苦労し、米国やオランダからもサンプルの提供をいただきました。近年、がんゲノム医療が始まり、本疾患が「がん遺伝子パネル検査」に想定外に多く出検されています。すなわち、臨床実地において担当医が治療に難渋していることがうかがえます。本研究をさらに発展させ、本疾患の早期発見や患者さんにお薬が届けることができるような研究を進めて参ります。
【用語説明】
※1 全ゲノム解析
次世代シークエンサーを使って、個人(約30億塩基対)やがんの全ゲノム情報を解読し、塩基配列の違いや変化を同定すること。タンパク質をコードする1〜2%の範囲のエクソンだけでなく、遺伝子の発現を制御するゲノム領域の変異や様々な構造異常(大きなゲノム配列異常)も検出可能である。
※2 転写因子
遺伝子の転写(DNAの情報をRNAへと写しとる過程)を制御するタンパク質群で、DNAに特異的に結合する。転写する過程を促進、あるいは逆に抑制し、細胞分化の運命決定などに寄与する。
※3 プロモーター領域のメチル化
DNA上には遺伝子の発現を制御する領域(プロモーター)があり、一般にこの領域がメチル化(DNA中の塩基の炭素原子にメチル化修飾が付加される化学反応)されると遺伝子の発現はオフに、脱メチル化されるとオンになる。
※4 ATAC-seq解析
Assay for Transposase-Accessible Chromatin Sequencing。ゲノムワイドでオープンクロマチン(ヌクレオソームのない領域)構造を選択的に検出・シークエンスすることによってゲノム全体で詳細に解析できる実験手法。
※5 構造多型
一般的には50 塩基以上の大きさの遺伝子異常。構造多型には、異常の種類によって、欠失、挿入、重複、逆位、転座などに分類されるが、それぞれが混在した複雑なパターンを示す構造多型も存在する。
※6 オルガノイド
生体内の細胞で見られる立体的な3次元構造を形作るよう培養された細胞。
※7 全ゲノム重複
ゲノム全体が倍加する現象で、生物の進化の過程でみられる。近年、がんのゲノムの進化でも観察されることが明らかになっている。
【お問い合わせ先】
<研究に関すること>
谷内田真一(やちだしんいち)
大阪大学 大学院医学系研究科 医学専攻 ゲノム生物学講座 がんゲノム情報学 教授
TEL: 06-6879-3360 FAX: 06-6879-3369
E-mail: syachida@cgi.med.osaka-u.ac.jp
国立がん研究センター研究所 ゲノム医科学分野 分野長
TEL: 03-3542-2511(代表) FAX:03-3542-2545
E-mail: syachida@ncc.go.jp
柴田龍弘(しばたたつひろ)
東京大学医科学研究所 附属ヒトゲノム解析センター ゲノム医科学分野 教授
TEL: 03-5449-5433 FAX:03-5449-5128
E-mail: tshibata@ims.u-tokyo.ac.jp
奥村 知之(おくむら ともゆき)
富山大学 学術研究部医学系 消化器・腫瘍・総合外科 講師
TEL: 076-434-7331 E-mail: okumura@med.u-toyama.ac.jp
廣野誠子(ひろのせいこ)
和歌山県立医科大学 医学部 外科学第2講座 講師
TEL: 073-441-0613 FAX:073-446-6566
Email: seiko-h@wakayama-med.ac.jp
岡野 圭一(おかの けいいち)
香川大学医学部消化器外科学 教授
TEL087-891-2438 FAX 087-891-2439
E-mail:okano.keiichi@kagawa-u.ac.jp
佐藤俊朗(さとう としろう)
慶應義塾大学医学部 坂口光洋記念講座(オルガノイド医学) 教授
TEL:03-5363-3063 FAX:03-3353-6247
E-mail:t.sato@keio.jp
<報道に関すること>
大阪大学大学院医学系研究科 広報室
TEL: 06-6879-3387 FAX: 06-6879-3399
Email: medpr@office.med.osaka-u.ac.jp
東京大学医科学研究所 国際学術連携室(広報)
TEL: 090-9832-9760
Email: koho@ims.u-tokyo.ac.jp
富山大学 総務部 総務課 広報・基金室
TEL: 076-445-6028 FAX: 076-445-6063
Email: kouhou@u-toyama.ac.jp
和歌山県立医科大学 事務局広報室
TEL: 073-441-0710 FAX: 073-441-0713
Email: kouhou@wakayama-med.ac.jp
香川大学医学部 総務課 広報法規・国際係
TEL087-891-2008 FAX 087-891-2016
E-mail:kouhou-m@kagawa-u.ac.jp
慶應義塾大学信濃町キャンパス 総務課
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho@adst.keio.ac.jp
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室
TEL: 03-3542-2511(代表) FAX:03-3542-2545
E-mail: ncc-admin@ncc.go.jp
<AMED事業に関すること>
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 次世代がん医療創生研究事業(P-CREATE)
電話番号:03-6870-2311
Eメール:cancer@amed.go.jp
PDFはこちら>>


