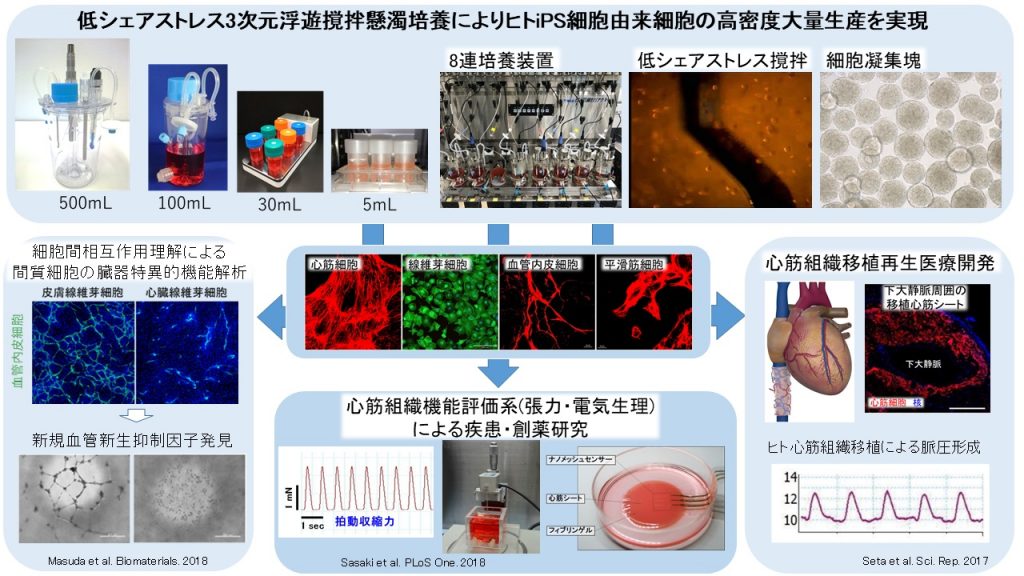
ヒトiPS細胞の大量培養技術開発を基盤としたヒト心筋組織構築と医療応用開発
ヒト多能性幹細胞は、再生医療、創薬・疾患研究における有望なヒト細胞ソースとして世界的に活用が進められています。一方で、その実用化および研究開発の加速には、安定的な目的細胞の量産化技術が不可欠です。本研究所では、培養容積当たりの細胞密度を最も高く設定可能である3次元浮遊 撹拌懸濁培養技術に着目し、エイブル株式会社との共同研究によって独自の撹拌翼を開発し、低シェアストレス撹拌によるヒトiPS細胞由来疑集塊の高密度大量培養に成功しました。条件検討用の小型バイオリアクターから実用化レベルのリッタースケールバイオリアクターの開発により、シームレスなスケールアップを可能とし、培地交換システムや培養環境モニタリング技術開発、大量生産後の後処理工程開発を通し、多能性幹細胞を用いた再生医療、創薬・疾患研究の実用化を推進しています。またハードウェア開発のみならず、培養技術の開発によりヒトiPS細胞の未分化大量増幅、心筋細胞を含む各種心臓構成細胞、膵島細胞、甲状腺濾胞細胞の量産化にも成功しています。本研究所で開発しました3次元浮遊 撹拌懸濁培養技術は、すでに国内外の多くの企業、大学等で活用されており、特に心筋細胞に関しては、ヒトiPS細胞由来心筋シート移植first in human医師主導治験の基盤技術となっています。
疾患・創薬研究は、動物モデルを用いた検討が主でありますが、種差の観点から、ヒト細胞への期待は高く、心臓のような実質臓器の機能は、組織・臓器を構成する様々な細胞の相互作用によって制御されることから、より生体に近い組織モデルの開発が望まれます。本研究所では、細胞のみから成る細胞シートとヒトiPS細胞由来心血管細胞の電気生理学的評価のみならず、単層心筋シートの張力測定システム、チューブ状心筋組織による脈圧測定システム、ドーム状心筋組織による拍出量測定システム開発を通し、心筋組織の様々な心不全の病態の分子機序の解明、さらには心筋組織の成熟化機構の解明を通し、創薬研究への応用も進めています。また、細胞シートを構成する細胞間の様々な相互作用と分子機序の理解は、生体組織・臓器の恒常性の理解にも繋がるものと期待しています。最近本研究所では、心臓線維芽細胞の血管新生抑制能とその責任因子LYPD1を発見し、様々な分子生物学的手法を駆使し血管新生抑制系を介した心臓の恒常性維持機構の解明や新規血管新生治療法の開発にも取り組んでいます。