高分子ミセル薬物キャリヤーシステム
がん化学療法では、代謝や排泄作用により非常に短時間で血中薬物濃度が低減し,長時間にわたって治療有効濃度に保つことは困難です。また、薬物自体は特定の組織・臓器に対する選択性がないために、正常組織にも大きな副作用を起こすケースが多く見られます。この問題を解決するために、合成高分子を薬物や遺伝子の運搬体(キャリア)として応用することで、標的部位に選択的に薬物を運搬し、副作用がきわめて少ない安全な薬物治療システムの確立を目的としています。
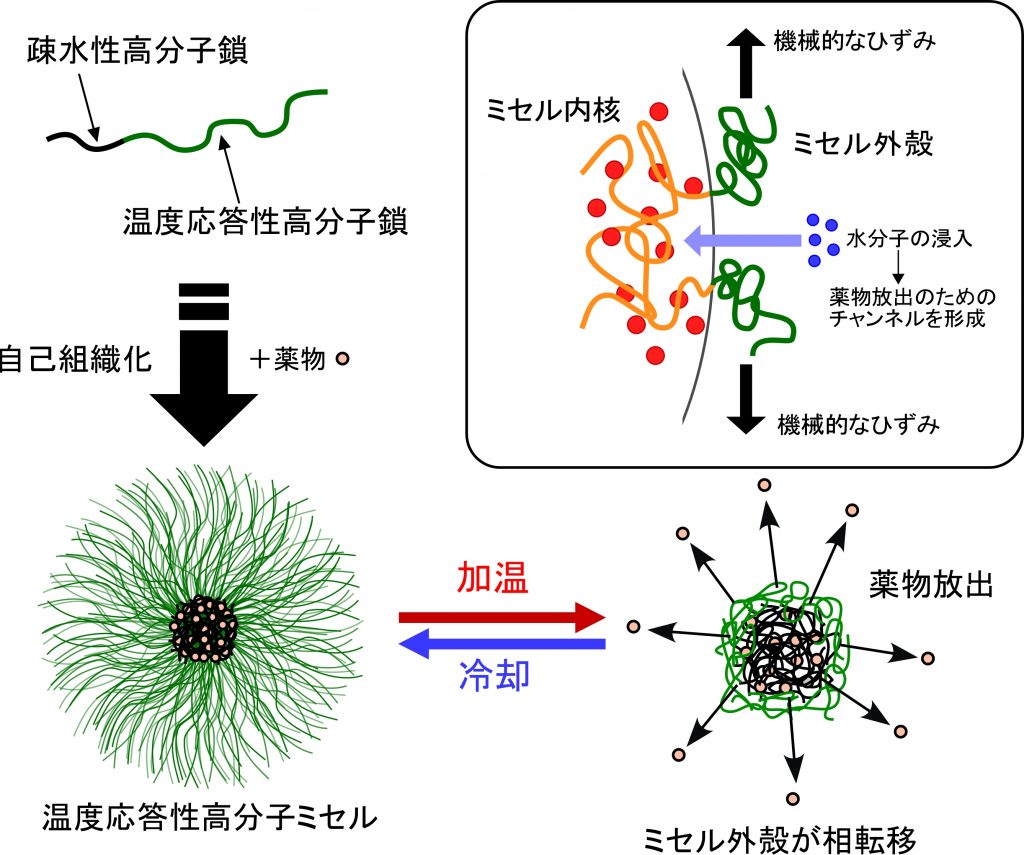
親水性-疎水性などの不均質な構造をもつブロック共重合体が、水中で自律的に会合した高分子ミセルの薬物キャリアとしての応用を検討しています。高分子ミセルの粒径は非常に小さく(10~100nm)、内核と外殻の明確な二層構造をもつために、外殻により生体との相互作用を通して体内動態・分布を決定し、内核には薬物を物理的あるいは化学的に封入することができます。
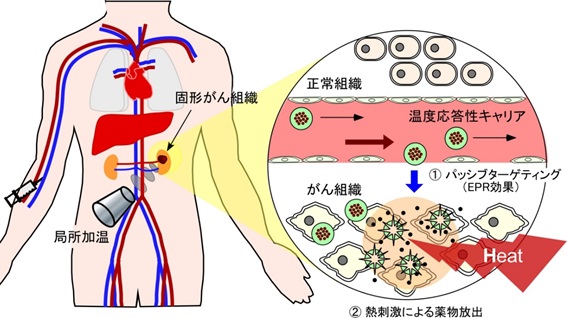
固形がん組織は、漏出性の高い血管構造と未発達のリンパ系をもつことから、ナノ粒子が集積しやすい特徴があります(Enhanced Permeability and Retention effect, EPR効果)。この特徴を利用して、抗がん剤を封入したナノサイズの微粒子製剤の開発が精力的に行われています。これまでに、生体適合性高分子として知られるポリエチレングリコールを外殻にもつ抗がん剤内包ミセルは、EPR効果により固形がん組織に高い集積性を示し、優れた抗がん活性を示すことが明らかとなっています。
現在、物理エネルギー(熱、電磁波、超音波など)を照射することで、薬物キャリアからの薬物放出をON-OFF制御するインテリジェント型薬物キャリアの開発に取り組んでいます。 EPR効果により薬物キャリアをがん組織に集積させた後に、患部のみにエネルギー照射することで、局所的な薬物放出を空間的かつ時間的に制御することが可能となり、副作用のさらなる低減と治療効率を飛躍的に高めることが考えられます。
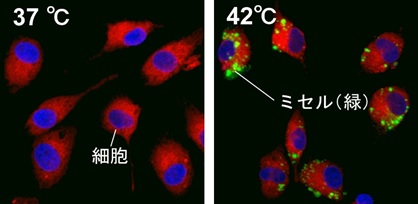
温度応答性高分子として知られるポリ(N-イソプロピルアクリルアミド)共重合体でミセル外殻を構成した、刺激応答性型の高分子ミセル型薬物キャリアを開発中です。このインテリジェント型薬物キャリアは、特定温度以上でミセル構造とその物性が大きく変化し、封入した薬物の放出速度を加速化したり、ミセル自体のターゲット細胞内への移行を促進させることができます。
がん近傍を42℃付近まで加温するがん温熱療法(局所ハイパーサーミア)と組み合わせることで、熱と薬物の相乗作用で効果的にがんを治療することが期待されます。